자폐 및 뇌 발달장애의 새로운 원인 밝혔다
기초과학연구원(IBS) 시냅스 뇌질환 연구단 김은준 단장 연구팀은 TANC2 단백질 결손이 자폐 및 뇌 발달장애를 유발하는 매커니즘을 규명했다. 이로써 TANC2 유전자 돌연변이에서 기인한 자폐 및 뇌 발달장애 치료제 개발에 크게 기여할 것으로 기대된다.
자폐증(Autism spectrum disorders)은 뇌 발달장애의 한 종류로서, 세계 인구의 약 2%가 앓고 있다. 뇌의 발달은 세포 내 다양한 신호전달(signaling) 체계에 의해 조절된다. 그중 ‘mTOR 신호전달’은 신경세포를 포함한 대부분 세포의 발달과 기능을 제어한다. 여기에는 대사 장애, 뇌 발달장애 등 다양한 질환이 관련되어 있다고 알려져 있다. 그러나 신경계에서의 mTOR 조절 기전은 이제까지 알려진 바가 거의 없었다.
* 자폐증(Autism spectrum disorders): 사회적 상호작용 및 의사소통의 결여와 반복적인 행동 및 제한된 관심의 증상을 보이는 일련의 뇌정신 질환.
* 뇌발달장애(Neurodevelopmental disorders): 자폐, 지적장애(intellectual disability), 주의력결핍-과잉행동장애 (ADHD), 뇌성마비(cerebral palsy) 및 조현병(schizophrenia) 등 비정상적인 뇌발달로 인해 유발되는 다양한 뇌정신질환을 통칭함. 전세계 인구의 약 15%가 앓고 있다.
* mTOR 신호전달 (mTOR(mechanistic Target Of Rapamycin) signaling): 인산화효소 단백질의 하나인 mTOR와 연관된 신호전달과정으로 세포의 사멸과 생존, 단백질 생산 등을 조절한다. 자폐 및 뇌 발달장애를 유발하는 FMRP, TSC1/2, PTEN 유전자의 돌연변이가 mTOR 신호전달 이상과 관련되어 있다.
시냅스 뇌질환 연구단은 이전 연구에서 ‘TANC2 단백질’이 정상적인 뇌 발달에 필수적임을 규명했다. 이후 다양한 임상연구를 통해 TANC2와 자폐 및 뇌 발달장애의 연관 가능성이 제기되었다. 다만 정확한 발병기전을 밝히지는 못했다. 이번 연구에서는 TANC2 단백질이 mTOR 단백질의 직접 억제자(negative regulator)로서 뇌 발달 및 기능을 조절함을 규명했다.
* TANC2 단백질 (Tetratricopeptide repeated, Ankyrin repeated And Coiled-coil domain-containing 2 protein): 경세포의 흥분성 시냅스 (synapse)에 존재하는 단백질로 신경세포의 발달에 중요한 기능을 하는 것으로 알려져 있으며 TANC2 돌연변이와 자폐 및 뇌질환의 연관 가능성이 보고되었다.
연구진은 TANC2 단백질과 mTOR 신호전달의 관계를 파악하고자 TANC2 발현이 절반으로 줄어든 자폐증 생쥐모델을 제작했다. 실험 결과, TANC2 단백질 결손이 mTOR 신호전달 단백질의 비정상적 과활성화로 이어져 시냅스 및 기억·학습 등의 뇌 기능이 저하되었다. 이때 mTOR 저해 약물인 라파마이신(Rapamycin)을 투여하면 시냅스 및 뇌 인지 기능이 정상으로 회복되었다. TANC2 단백질이 mTOR 신호전달 단백질을 저해하여 뇌 기능을 조절한다는 의미다.
나아가 인체의 신경세포에서 TANC2가 줄어들면 mTOR 신호전달체계가 비정상적으로 활성화됨도 발견했다. 인간의 신경계에서도 TANC2가 mTOR 저해인자로서 뇌 발달 및 뇌 기능을 조절하는 것이다.
김은준 단장은 “이번 연구로 최근 자폐 및 뇌 발달장애의 원인으로 부상한 TANC2 유전자 변이의 발병 메커니즘을 밝혔다”며,“후속 연구를 통해 mTOR 신호전달 억제제를 TANC2 유전자 돌연변이에서 기인한 자폐 및 뇌 발달장애의 치료에 활용할 수 있을 것”이라고 전했다.
연구결과는 국제 학술지 네이처 커뮤니케이션즈(Nature Communications, IF 12.121) 온라인판에 2021년 5월 11일 18시(한국시간)에 게재되었다.
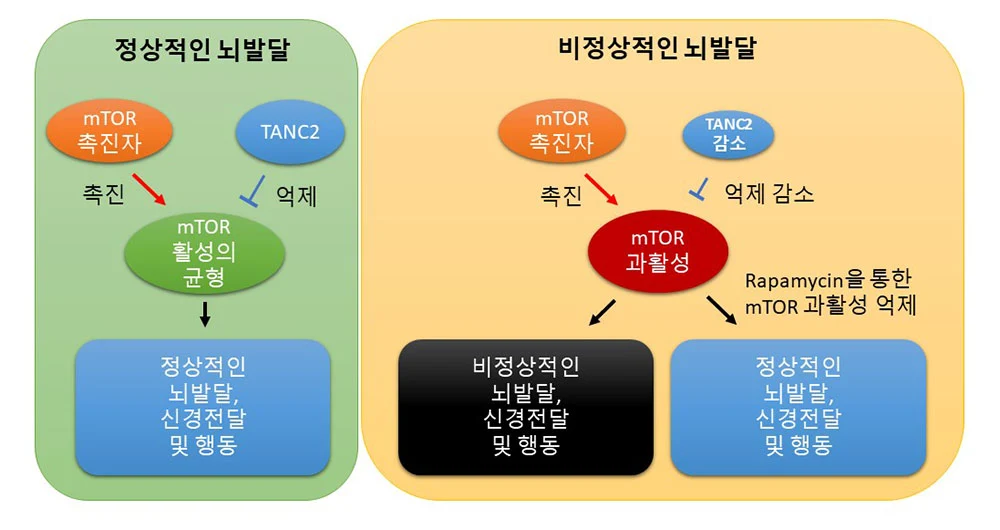 |
| ▲ TANC2에 의한 mTOR 신호전달체계의 균형 유지 모식도 |
정상적인 뇌발달 상황에서 mTOR의 활성은 촉진자(positive regulator)와 억제자(TANC2; negative regulator)에 의해 균형 있게 조절되며 정상적인 뇌발달, 신경전달 및 행동을 매개한다. 그러나, TANC2의 양이나 기능이 감소하면 그 균형이 깨져서 mTOR의 과활성화가 초래되고 비정상적인 뇌발달, 신경전달 및 행동이 유발된다. 반면 Rapamycin과 같은 mTOR 억제 약물을 투여하면 mTOR 과활성이 억제되고 정상적인 뇌발달, 신경전달 및 행동을 회복시킬 수 있다.
 |
| ▲ TANC2 결손 생쥐의 대뇌에서 mTOR 신호전달이 활성화됨 |
생후 2주령 (Postnatal day 14) 정상 생쥐와 TANC2결손 생쥐의 대뇌 조직에서 mTOR 신호전달 체계에 속한 신호전달 단백질들의 인산화 변화를 비교하였을 때, 특히 mTOR 및 mTOR 하위단계에 있는 단백질들의 활성화 (단백질 인산화의 증가)가 관찰되었으며 (좌측 패널), 이와 상관 없는 단백질들은 (우측 패널) 변화가 없는 것을 확인하였다.
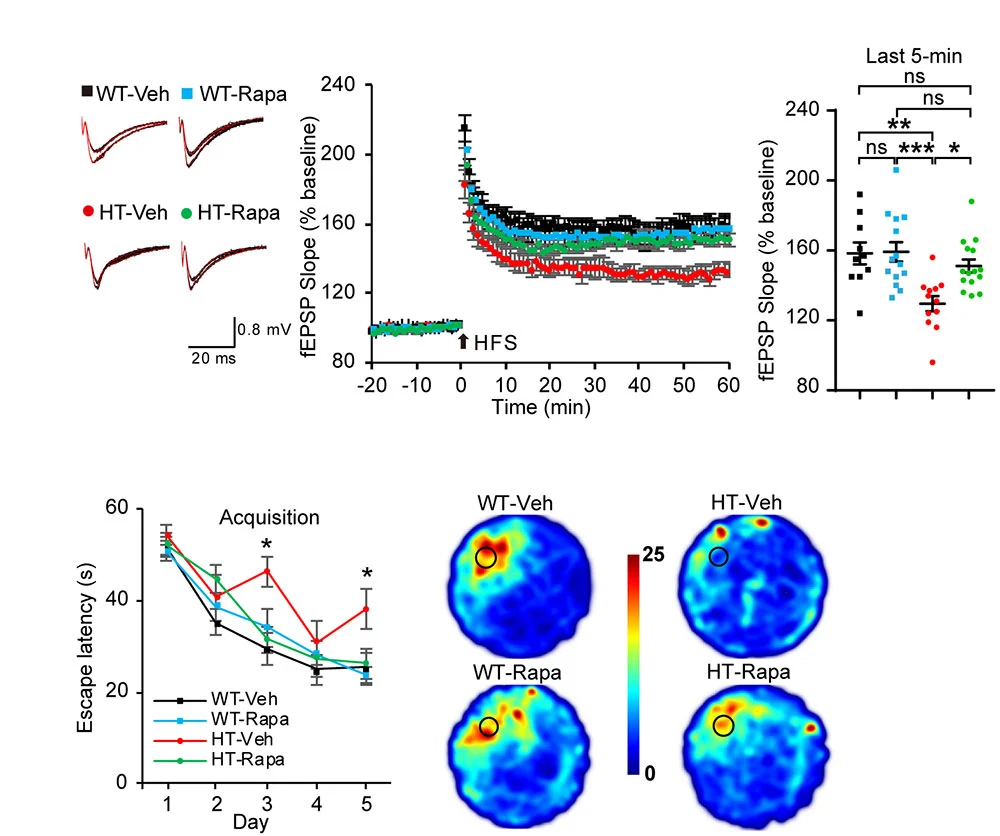 |
| ▲ TANC2 결손에 의한 신경전달의 변화와 기억 및 학습 능력의 감소가 mTOR 저해제인 Rapamycin에 의해서 정상으로 회복됨 |
TANC2 결손이 신경세포 시냅스의 형성에 영향을 미치는지 확인하기 위해 TANC2 결손 생쥐 뇌의 해마 부위에서 시냅스 기능의 하나인 신경전달 가소성(Long-term potentiation 또는 LTP)을 측정하였을 때 (상단), TANC2 결손 생쥐에서 (HT-Veh) 감소되어 있던 LTP가 Rapamcyin 처리시 (HT-Rapa) 정상으로 회복된다. 정상 생쥐에서는 Rapamycin 처리시 LTP에 변화가 없다 (WT-Veh 및 WT-Rapa). 또한 TANC2 결손 생쥐는 수중미로 실험(하단)에서 기억 및 학습 능력의 감소를 보이는데 (HT-Veh), Rapamycin 처리에 의해 회복됨 (HT-Rapa). 이는 TANC2의 결손이 시냅스 및 뇌인지 기능을 조절하며, Rapamycin이 TANC2 결손으로 초래되는 비정상적 시냅스 및 뇌인지 기능을 회복시킬 수 있음을 의미한다.
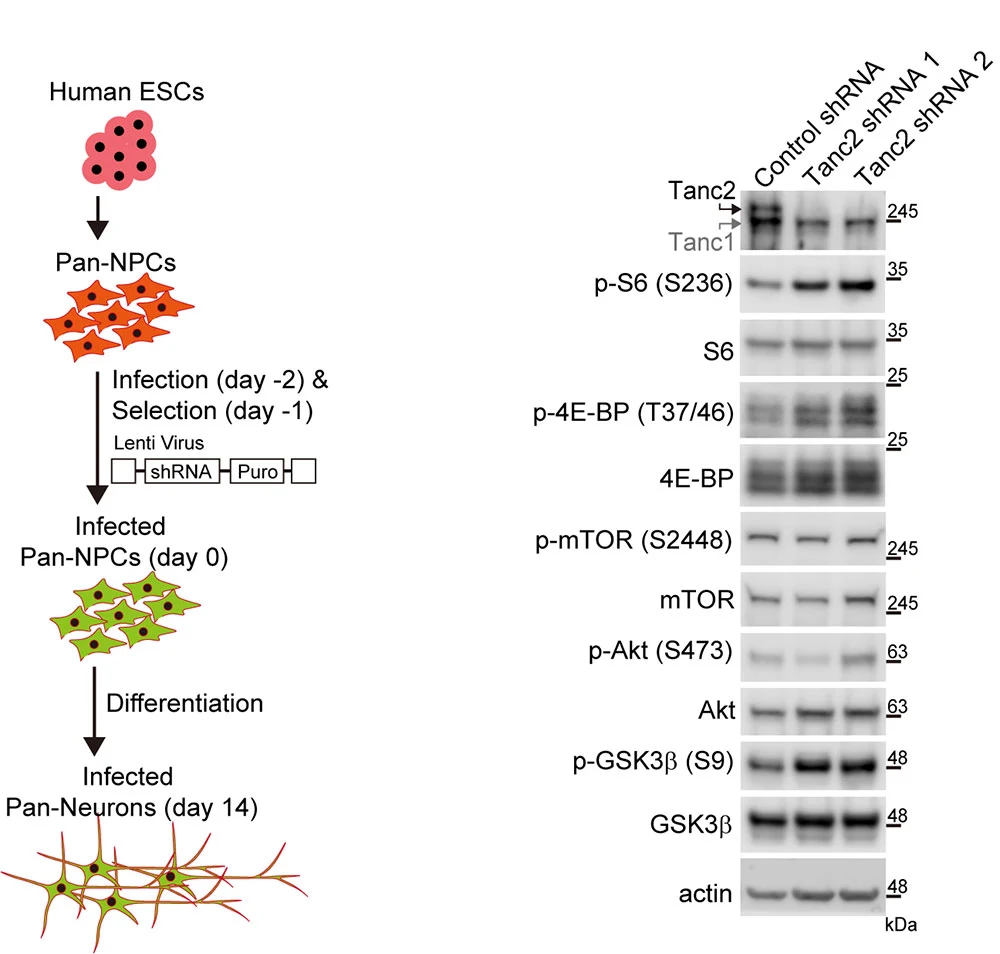 |
| ▲ 인간 줄기세포 유래 신경세포에서 TANC2의 발현을 감소시켰을 때 mTOR 신호전달체계의 과활성이 나타남 |
인체 유래 배아줄기세포인 HuES6 줄기세포로부터 분화시킨 인간 신경세포에서 TANC2 발현을 감소시켰을 때 mTOR 신호전달체계에서 mTOR 하위단계 단백질들인 S6, 4E-BP, GSK3beta의 활성화(인산화)가 증가하는 현상을 보인다. 이는 TANC2의 생쥐뿐만 아니라 인경의 신경세포에서도 mTOR를 억제함을 의미한다.
출처: 기초과학연구원


